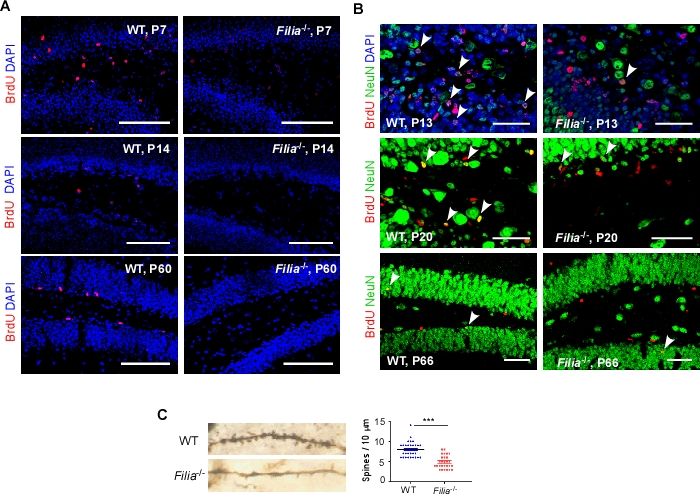
12月31日,《美国国家科学院院刊》(PNAS)在线发表了题为Crystal structure of human LDB1 in complex with SSBP2 的论文,该项工作由中国科学院生物物理研究所许文青/梁栋材课题组和美国国立卫生研究院Ann Dean课题组合作完成。
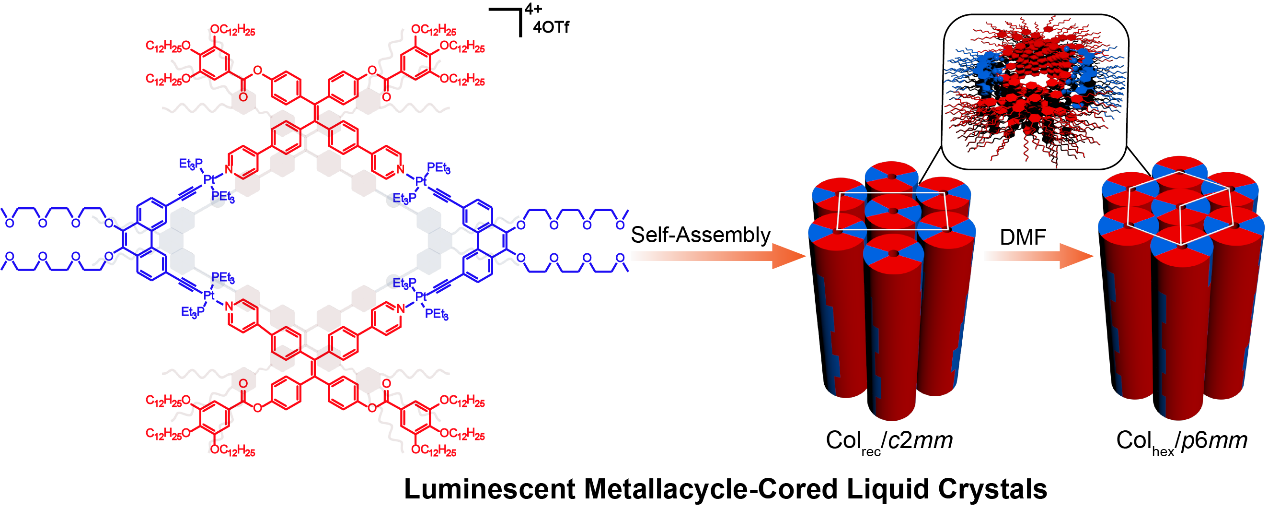
增强子是一种控制基因表达与否的开关,它们往往远离其控制的基因,坐落于编码框之外。因此,距离基因很远的增强子和基因之间的DNA成环是基因转录激活非常关键的一步。在哺乳动物红细胞中,LDB1蛋白虽然自身不结合DNA,但是分别结合在远距离增强子和红细胞生成相关基因上的LDB1转录复合物,可通过LDB1的二聚体化实现远距离增强子和启动子之间的互作。LDB1-SSBP复合物是多种重要蛋白复合物如Wnt增强子复合物和LDB1转录复合物的核心复合物,对发育至关重要。SSBP蛋白阻止LDB1蛋白在26S蛋白酶体中被降解,维持LDB1复合物的稳定性,进而促进转录复合物的装配,调控基因的表达。但是LDB1与SSBP如何相互作用和LDB1如何形成同源二聚体的分子机制尚未被揭示。
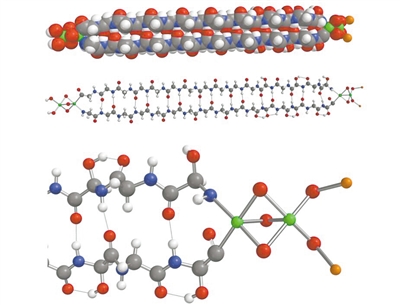
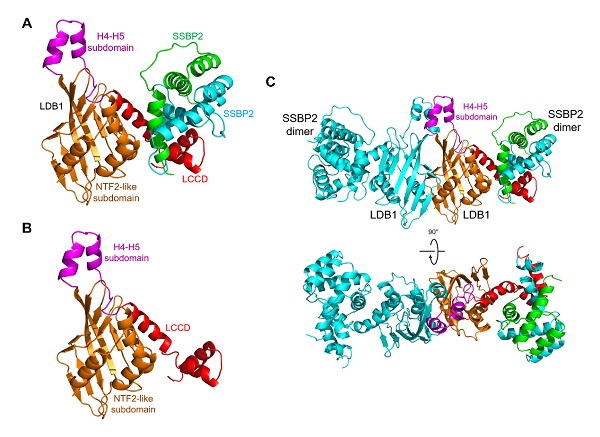
该论文首次报道了LDB1/SSBP2复合物的晶体结构。作者发现LDB1二聚体结构域(DD)包含一个N端核转运因子2(NTF2)样子结构域和一个由α螺旋4和α螺旋5组成的子结构域,它们共同构成了LDB1二聚体作用面。LDB1二聚体的两个LDB/Chip保守结构域(LCCD)位于核心DDs的侧面,每个LCCD与SSBP2二聚体形成广泛的相互作用。LDB1 DD和LCCD之间的保守linker覆盖了LDB1 NTF2-like子结构域的潜在的配体结合口袋,这可能成为LDB1结构和功能的调控位点。此外,该文中的结构和生物化学数据为理解LDB1和LDB1/SSBP2相互作用如何成为调控细胞选择决定和长距离增强子-启动子相互作用的不同复合物的结构核心,提供了结构基础。
该工作主要由生物物理所许文青/梁栋材课题组完成。许文青、闫小雪和Ann Dean是该论文的共同通讯作者,许文青/梁栋材课题组的博士研究生王红杨为该论文的第一作者。这项工作得到生物大分子国家重点实验室、国家自然科学基金和中科院战略性先导科技专项的资助和支持。